식약당국의 의료기기 부작용 등 사후관리가 엉망인 것으로 드러났다. 부작용으로 환자가 사망하거나 인체 위해성이 높은 기기의 경우 추적관리기기로 지정해 관리해야 하는데도 3개 기기에 대해 검토조차 하지 않았고, 국내 허가도 없는 24개 기기는 향후 허가에 대비한다는 사유로 추적관리기기로 관리하고 있었다. 추적관리대상 의료기기에 대한 지정 및 관리 기준과 절차가 마련돼 있지 않아서 주먹구구식으로 관리되고 있는 것이다.
이 같은 사실은 감사원이 2일 공개한 '의료기기 안전 및 품질관리 실태' 감사보고서를 통해 확인됐다. 감사는 작년 8월 30일부터 10월15일까지 진행됐다.

감사원에 따르면 식약처는 의료기기법에 따라 사용 중 부작용 또는 결함 발생으로 신체에 치명적 위해를 줄 수 있어서 그 소재를 파악해 둘 필요가 있는 의료기기를 추적관리기기로 지정해 관리하고 있다.
지정된 추적관리기기는 감사 시점인 2021년 8월 31일 기준 총 52개 품목이다.
이와 관련 감사원이 식약처 산하 의료기기정보원이 2013년부터 2020년까지 수집·분석한 부작용 정보를 분석한 결과, '뇌혈관내색전촉진용보철재'는 부작용으로 8년간 환자 23명이 사망했는데도 추적관리기기로 지정되지 않는 등 3개 의료기기가 부작용으로 환자가 사망했거나 인체 위해성이 높은 기기로 평가되는 등 인체에 치명적인 위해가 우려되는데도 추적관리기기로 검토조차 되지 않았다.

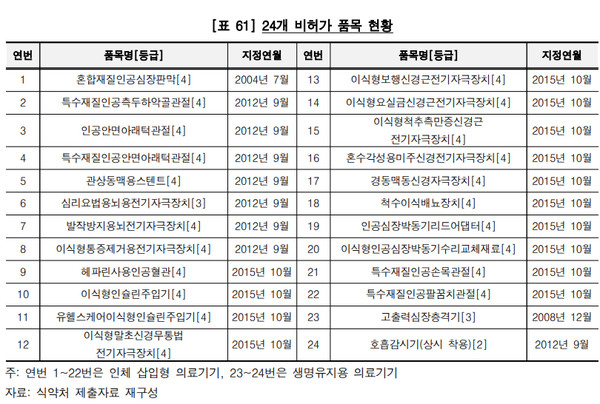
그런데 거꾸로 국내 허가되지 않은 다수 품목은 추적관리기기로 관리되고 있었다. 실제 감사원이 52개 추적관리기기의 허가 및 유통 실태를 분석한 결과, '혼합재질인공심장판막' 등 24개 기기는 지정 후 2021년 8월31일 현재까지 짧게는 6년 10개월에서 길게는 17년 1개월 동안 품목허가가 없는 것으로 확인됐지만 식약처는 향후 국내 허가에 대비한다는 사유로 해당 품목을 추적관리기기로 유지하고 있었다.
이와 관련 감사원은 "식약처장은 사망사고가 발생한 주요 의료기기가 추적관리대상으로 지정·관리되지 못하거나 추적관리 필요성이 적은 의료기기가 지정·관리되는 일이 없도록 추적관리대상 의료기기의 지정·관리에 관한 구체적 기준과 절차를 마련해 추가 지정 및 해제 필요성 등에 대해 주기적으로 검토하는 방안을 강구하라"고 통보했다.
이에 식약처는 "감사결과를 수용하면서 앞으로 추적관리기기의 지정·관리에 관한 구체적인 기준과 절차를 마련해 추가 지정 여부 등을 주기적으로 검토하고, 미국 등 주요국의 추적관리제도 운영현황, 의료기기 이상사례 정보 등을 반영해 관리하겠다"는 의견을 감사원에 제출했다.



